
Парообразование

Почти все вещества в зависимости от температуры и давления могут находиться в трех агрегатных состояниях — газообразном, жидком и твердом.
Вещество может переходить из одного афегатного состояния в другое.
Эти смены состояния называют фазовыми переходами.
Для веществ в газообразном состоянии используют два названия: газ и пар
До XIX в. считалось, что одни вещества при достаточно сильном сжатии можно перевести из газообразного состояния в жидкое, а другие нельзя.
Первым дали название пар (когда они находятся в газообразном состоянии), а вторым — название газ или постоянный газ.
Однако в 1877 г. были сжижены постоянные газы кислород и азот, а в 1898 г. — водород.
Оказалось, что всякое вещество можно перевести из газообразного состояния в жидкое при условии, что его температура будет ниже некоторого значения; эту температуру назвали критической температурой.
Для различных веществ она различна
Например, для диоксида углерода С02 она равна 304 К (31 °С),
для кислорода 155 К (-118°С),
для азота 126 К (—147 °С),
для водорода 33 К (—240 °С),
для оксида водорода Н20 критическая температура 647 К (374 °С),
для ртути 1460 К (1187 °С).
Если температура вещества выше его критической температуры, то это вещество ни при каком давлении не переходит из газообразного состояния в жидкое, а тем более в твердое.
Если, например, температура оксида водорода окажется выше 374 °С, то никаким сжатием нельзя будет получить из него воду или лед.
Если ртуть нагреть выше 1187 °С, то она окажется в газообразном состоянии, из которого никаким сжатием не удастся перевести ее в жидкое состояние.
В настоящее время принято называть паром вещество в газообразном состоянии, находящееся при температуре ниже критической для данного вещества, и газом — при температуре выше критической.
Принципиальной разницы между паром и газом, таким образом, нет.
Критическая температура азота, кислорода, водорода ниже —100 °С, т. е. существенно ниже обычно используемых температур; поэтому азот, кислород, водород принято именовать газами.
Каждый из них может стать паром (а также жидкостью и даже твердым телом) при достаточно низких температурах. А вот у оксида водорода Н20 критическая температура равна 374 °С; она много больше обычных температур, поэтому принято говорить не о водяном газе, а о водяном паре.
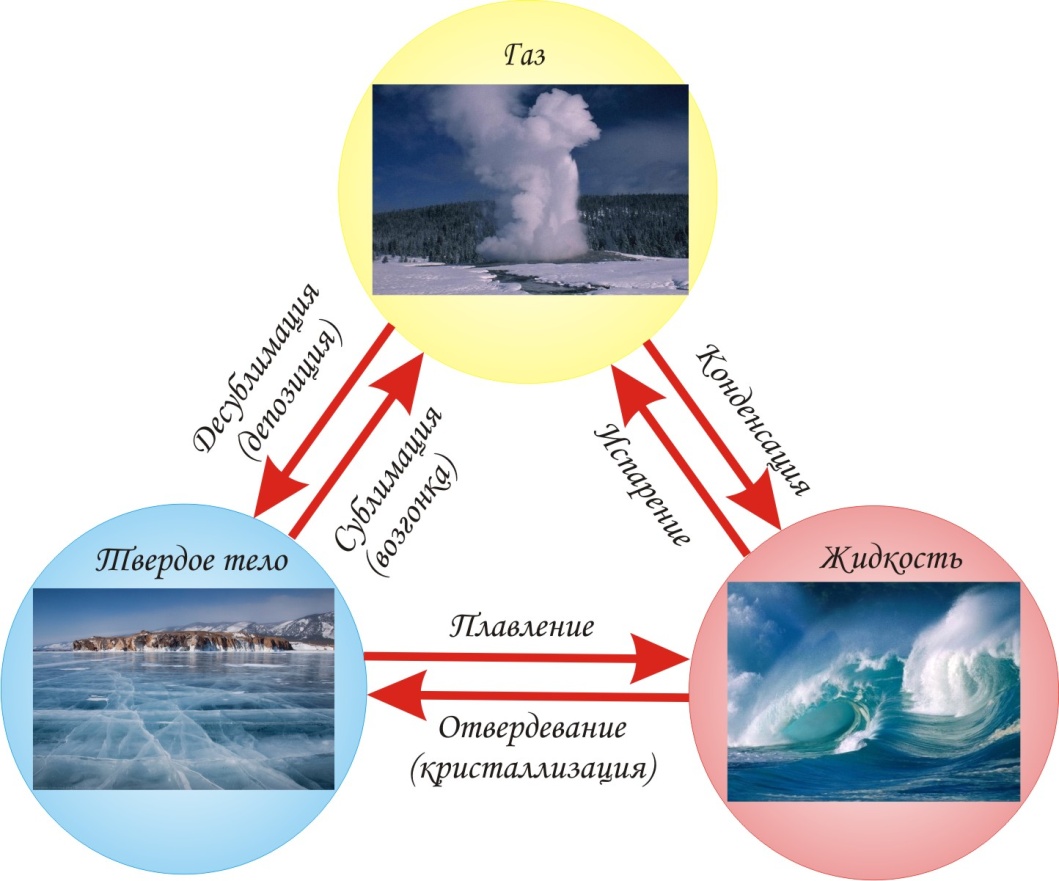
Фазовый переход того или иного вещества из жидкого состояния в газообразное называют парообразованием или испарением (особым случаем парообразования является кипение), обратный переход называют конденсацией в жидкое состояние или проще — конденсацией.


Фазовый переход вещества из твердого состояния в жидкое называют плавлением, обратный переход —отвердеванием. Если вещество превращается из жидкости в твердое тело, обладающее кристаллической атомной решеткой, т. е. являющееся кристаллом, то в этом случае процесс отвердевания называют также кристаллизацией.

Фазовый переход вещества из твердого состояния сразу в газообразное называют сублимацией или возгонкой, обратный переход называют конденсацией в твердое состояние.
Рассматриваемые фазовые переходы сопровождаются либо поглощением, либо выделением энергии
Предположим, что требуется превратить некоторую массу жидкости в пар той же температуры, что и у жидкости. Для этого надо затратить определенную энергию, зависящую не только от выбора жидкости, но и от ее температуры.
Эта энергия пойдет на увеличение внутренней энергии вещества.
Энергию, требующуюся для превращения единичной массы жидкости в пар той же температуры, называют удельной теплотой парообразования данной жидкости.
Ее единица измерения — Дж/кг.
Парообразование (испарение) может происходить при любой температуре ниже критической. Лишь в случае кипения требуется определенная для каждого вещества температура (точка кипения), которая зависит от
внешнего давления. При повышении температуры удельная теплота парообразования уменьшается и в конечном счете обращается в нуль, когда достигается критическая температура.
При конденсации единичной массы пара в жидкость той же температуры происходит высвобождение энергии, равной удельной теплоте парообразования.
Из сказанного можно сделать вывод: чтобы испарить некоторую массу жидкости, необходимо сообщить ей соответствующую энергию, а для конденсации пара надо, соответственно, позаботиться об отводе соответствующего количества энергии.
На практике все это происходит без специального вмешательства извне. Необходимая для парообразования энергия заимствуется из окружающей среды. Ведь в процессе парообразования жидкость покидают в первую очередь молекулы с большей энергией, жидкость начинает охлаждаться, что стимулирует теплопередачу со стороны окружения. Если же эта теплопередача не успевает произойти достаточно быстро (что как раз и наблюдается в адиабатных процессах), то испарение будет сопровождаться понижением температуры вещества. Соответственно, при конденсации пара в жидкость высвободившаяся энергия приводит к повышению температуры.
Напомним фазовые переходы между его агрегатными состояниями
-Водяной пар конденсируется в капельки воды и кристаллы льда.
-Кристаллы льда тают, превращаясь в водяные капли, или сублимируют, превращаясь в водяной пар.
-Капли воды испаряются, превращаясь в водяной пар, или замерзают, становясь кристаллами льда.
Поэтическая фраза «в небе тают облака» не имеет отношения к физическому процессу таяния льда или снега; она
переводится на язык физики так: «в небе происходят процессы испарения и сублимации».